Effect of Moisture on High Hydrostatic Pressure Treated Waxy Maize Starch and Tapioca Starch
-
摘要: 利用高静压(HHP)作为物理变性方法处理糯玉米淀粉和木薯淀粉,考察水分含量对不同类型淀粉的糊化及重结晶的影响。用偏光显微镜、扫描电子显微镜观测HHP处理后淀粉颗粒的形态变化,利用激光粒度分析仪记录淀粉颗粒的粒度分布及变化规律,结合X射线衍射曲线及低场核磁共振图谱, 分析淀粉颗粒内水分的结合方式及程度。结果表明:当粉水比(淀粉质量和水质量之比)为3/10~5/10时,在HHP处理下,两种淀粉均发生结晶解体和溶胀现象。糯玉米淀粉的重结晶程度顺序为4/10粉水比 > 3/10粉水比 > 5/10粉水比; 木薯淀粉颗粒结晶结构完全消失,结晶破坏的程度是3/10粉水比 > 4/10粉水比 > 5/10粉水比。随着水分含量增大,糯玉米淀粉及木薯淀粉的粒度逐渐增大。干燥后淀粉中的水分主要以结合水的形式存在,且水分参与结晶结构的形成。Abstract: Waxy maize and tapioca starch with different starch-water ratios were treated by high hydrostatic pressure (HHP)-a physical modification method-under 600 MPa.The effects of moisture content on gelatinization and retrogradation properties of the two kinds of starch were investigated.The appearance and particle size of granules were studied by micro-polariscopy, scanning electron microscopy and laser diffraction instrument.Combining the X-ray diffraction and nuclear magnetic resonance (NMR) spectrum, the change from crystal to non-crystal was confirmed again, and the water status in starch was studied, too.The results indicate that the crystalline structure destroying and gelatinization happen when the starch-water ratio was between 3/10 and 5/10.The degree of retrogradation for waxy maize starch was 4/10 > 3/10 > 5/10 (starch-water ratio), whereas the degree of crystalline structure destroying for tapioca starch was 3/10 > 4/10 > 5/10 (starch-water ratio).The diameter of waxy maize and tapioca starch granules increased significantly with moisture content.Water was kept within the crystalline lamella in the form of bond water.
-
Key words:
- high hydrostatic pressure (HHP) /
- water /
- starch /
- gelatinization /
- retrogradation
-
1. 引言
高静压(High Hydrostatic Pressure, HHP)技术是指在室温或温和条件下利用0.1~2 GPa的压力处理, 以达到杀菌或加工食物原料的目的。HHP处理使食品自身体积减小, 即在生物体高分子的立体结构中发生氢键结合、离子结合和疏水结合, 其结果不仅会影响生物细胞形态, 还能改变生物高分子立体结构, 引起蛋白质、酶等失活, 从而成为非热杀菌的手段之一[1]; HHP对维生素、色素和风味物质等低分子化合物的共价键无明显影响, 故可用于改善食品组织结构或生成新型食品。HHP技术能够在不加热或不添加化学防腐剂的条件下, 保证食品安全, 并显著延长食品的冷藏期和货架期, 所得加工产品的质量是传统加工产品无法媲美的, 为生产高附加值的产品提供了很好的技术手段[2]。
早在1899年, Hite将原奶在室温下用600 MPa高压处理1 h, 使其贮藏期延长了4 d[3]。Bridgman因发现静水压下蛋白质的变性、凝固现象, 而获得了1946年的诺贝尔物理学奖。但直到1990年, HHP技术相关理论和装备的研究才有所突破与发展。日本首先实现了HHP技术在果汁、沙拉酱、果酱、海鲜、果冻等食品加工领域的商业化应用[4]。2000年, 日本越后制果株式会社成功推出了采用HHP技术加工的方便米饭, 不仅方便、口感好, 而且充分地保留了米饭原有的营养成分, 成为目前日本最热销的超高压食品。加工海鲜类产品时, HHP技术不仅便于脱壳, 还能改善产品品质并延长货架期。目前, HHP加工的果蔬制品和肉制品在一些发达国家已经达到商业化生产的水平, 如鳄梨、草莓、苹果、猕猴桃等酱类制品[5]。据不完全统计, 目前全球采用HHP技术加工的食品超过13万吨(数据来自NC Hyperbaric, 不包括亚洲)。
自1982年第一篇关于超高压处理淀粉的论文发表以来, 至今已有20多种淀粉被HHP处理过, 包括:A型的小麦、大麦、燕麦、黑麦、玉米、黏玉米、稻米、黏稻米、花生、苋菜红、高粱淀粉, B型的马铃薯、木薯淀粉等, C型的美人蕉、豌豆、木薯、小扁豆、绿豆、莲、巴巴苏仁、板栗淀粉等[6-7]。
除了处理压力外, 另一个影响HHP淀粉结构的主要因素是水分含量。淀粉分子拥有众多羟基, 亲水性很强, 羟基之间通过氢键结合, 淀粉颗粒中的水分子也参与氢键的结合[8]。淀粉颗粒具有相当高的渗透性, 水和水溶液能自由进入淀粉颗粒内部。在HHP处理下, 淀粉颗粒受压缩, 因此颗粒结晶结构的变化过程成为颗粒吸水膨胀和高压抑制膨胀两个相反作用力的博弈, 反映在淀粉颗粒结构上也有不同的表现。Vainionpaa等人[9-10]研究发现, 在有限的水分范围内, 压力处理加速破坏淀粉颗粒中的有序结构, 有利于淀粉的融解, 或增强淀粉的可塑性[11]。
对于淀粉颗粒中水分子的存在方式, 有两种不同观点:一种认为水分子参与结晶, 依据是淀粉在逐步加热、干燥、脱水过程中, 由于晶体结构中水分子的脱除, 颗粒由结晶结构转化为无定形结构[8]; 另一种认为水分子并不参与结晶, 该观点由法国科学家Kainuma提出, 他把浸透玉米糖浆的淀粉糊精干燥至完全脱水状态, 发现淀粉仍然保持结晶结构[12]。Perry等人[13]应用小角中子散射方法, 研究了不同种类淀粉颗粒内部水分的分布, 实验结果显示, 无定形区内的水分含量远大于结晶区, 因此无定形区具有更开放的渗透性结构。本研究将从水分含量的角度出发, 研究高静压过程中不同类型淀粉的微观结构。
2. 实验材料与方法
2.1 实验材料处理
糯玉米淀粉(A型, 含微量直链淀粉)从国民淀粉上海分公司购得, 初始水分含量为12.77%, 蛋白质含量为0.48%, 灰分含量为0.51%;木薯淀粉(C型, 含17%直链淀粉)由广西武鸣安宁淀粉有限公司友情赞助, 水分含量为6.74%, 蛋白质含量为0.62%, 灰分含量为0.68%。用淀粉和蒸馏水配制成粉水比(淀粉质量和水质量之比)为1/10、3/10、5/10、7/10及1的溶液, 室温条件下搅拌均匀后, 装入聚乙烯袋中, 进行真空封口。将密封好的样品放入高静压处理釜中进行高压处理, 压力水平为600 MPa, 保压时间为30 min。高静压设备(HHP-750)由包头科发高压科技有限公司与中国农业大学国家果蔬工程中心联合研制, 传压介质为蒸馏水, 最大工作压力是600 MPa。让处理后的样品迅速在室温条件下进行冷冻干燥, 粉碎, 在4 ℃下保藏。
2.2 实验方法
2.2.1 光学显微镜观察
采用上海光学仪器厂生产的光学显微镜(59XA), 放大倍数为400(40×10)倍。按以下步骤操作:将样品配制成1%的淀粉乳, 取1滴放在载玻片上, 盖上盖玻片后置于光学显微镜下观察、拍照; 分别记录淀粉在正常光源及偏振光源下的形貌特征。
2.2.2 扫描电子显微镜(SEM)观察
采用日立公司的扫描电子显微镜(HITACHI S-3400N, Japan)。将双面胶带贴于扫描电子显微镜的载物台上, 用牙签粘取少量样品, 轻轻地在双面胶上涂抹均匀, 用吸耳球吹去多余的淀粉样品, 放入表面处理机中, 用离子溅射镀膜仪喷碳镀金2 h取出; 将载物台放入扫描电子显微镜中观察, 拍摄具有代表性的淀粉颗粒形貌。电子枪加速电压设为2 kV, 以减少对淀粉颗粒的破坏。
2.2.3 粒度分布分析
采用美国贝克曼库尔特有限公司的激光粒度分析仪(LS230)。将0.1 g淀粉溶于5 mL无水乙醇, 振荡10 min使淀粉颗粒分散均匀, 并用无水乙醇作分散剂, 按照仪器提示加入所需量的样品, 进行分散。在1 800 r/min转速下, 测定淀粉颗粒的微分粒度分布和颗粒分布的平均直径, 每件样品测3次。
2.2.4 X射线衍射分析
利用日本岛津公司的XRD-6000型X射线衍射仪进行淀粉晶体的X射线衍射分析。分析条件:特征射线CuKα, 石墨单色器, 管压40 kV, 电流30 mA, 测量角度范围为2θ=4°~40°, 发射及防反射狭缝为1°, 接收狭缝宽0.3 mm, 扫描速度为1.5°/min, 步宽0.05°。为了避免不同样品中相对水分含量的差异影响相对结晶强度, 测量前应先将淀粉样品在室温下置于相对湿度100%的干燥皿中平衡48 h。
2.2.5 低场核磁共振分析
采用纽迈公司的核磁共振成像仪(PQ001), 磁场强度0.5 T, 线圈直径15 mm, 频率21.961 MHz, 温度31.99~32.00 ℃。实验前, 将淀粉样品烘干, 粉碎, 过200目筛后, 装入15 mm玻璃试管即可测试。
2.2.6 数据处理及分析
实验数据采用SPSS 16.0 for Windows统计分析软件和Microsoft Excel 2003数据处理系统进行统计处理, 计算标准偏差(±SE)或进行差异显著性分析(显著性水平取0.05), 并利用Origin 7.5数据分析和制图软件做实验数据图。各实验均重复进行3次。
3. 实验结果与讨论
3.1 颗粒形貌
3.1.1 糯玉米淀粉
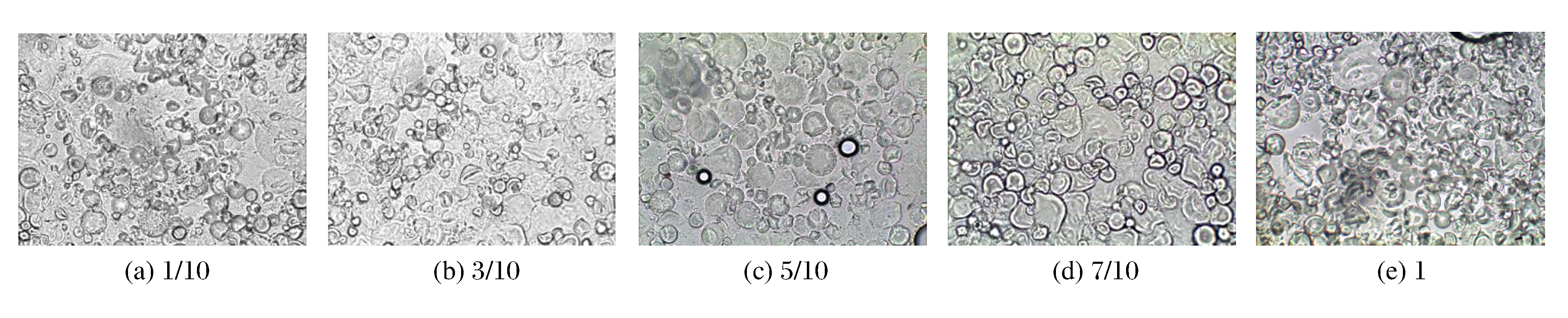
从图 1~图 4中可以看出, 当淀粉与水的比例不同时, 颗粒吸水膨胀的程度不同, 但颗粒之间都有不同程度的粘连。粉水比为1/10的样品水分含量高, 颗粒最光滑(见图 3(a)、图 4(a)), 原因是粉水比较低, 颗粒相互作用机会减少, 难以互相粘连变形。粉水比为7/10和1的样品颗粒水分含量少, 颗粒发生竞争性吸水, 表现出膨胀的不均匀性(见图 3(d)、图 3(e))。粉水比为3/10及5/10的样品颗粒已丧失自身形状, 发生变形(见图 1(b)、图 1(c)和图 2(b)、图 2(c)), 且出现很多碎片(见图 3(b)、图 3(c)), 淀粉颗粒充分膨胀, 粘连并聚合(见图 4(b)、图 4(c))。在600 MPa压力下, 糯玉米淀粉经历颗粒膨胀阶段[14-15], 颗粒的结晶结构完全破坏; 但是从偏光显微照片发现, 存在偏光十字, 说明糯玉米淀粉在经历HHP吸水膨胀之后, 颗粒内部的支链淀粉分子立刻发生重排[7], 表现出重结晶现象。
高静压糊化的淀粉分子处于无序的高能态, 由于分子间势能的作用, 淀粉分子趋于有序重排, 结晶重新趋向平行排列, 形成具有结晶结构的白色凝沉物, 称为重结晶[16]。Mile等人认为, 淀粉重结晶可分为两个阶段, 即短期重结晶和长期重结晶。短期重结晶主要是由于直链淀粉胶凝有序和结晶, 该过程可在糊化后较短时间内完成, 一般为几小时或十几小时。长期重结晶则主要由支链淀粉的外支链间有序堆积所引起, 是一个缓慢长期过程, 一般以天计[16]。糯玉米淀粉几乎不含直链淀粉, 因此属于长期重结晶过程[16]。
3.1.2 木薯淀粉
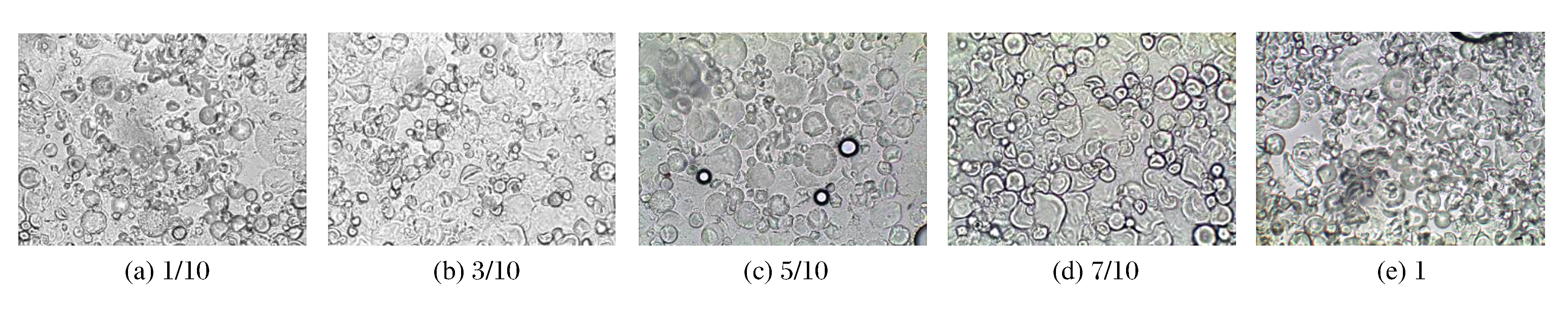
淀粉颗粒具有竞争占有水分的特点, 因此当水分含量发生变化时, 颗粒并不能全部在HHP的作用下发生吸水溶胀。如图 6所示, 木薯淀粉中粉水比为1/10、7/10及1的3组样品中, 偏光十字都未完全消失, 说明水分含量太高或太低都会影响淀粉的吸水膨胀及结晶结构变化。水分含量过高, 淀粉颗粒相互作用的机会减小, 颗粒膨胀程度较大(见图 7(a)), 但不能互相粘连(见图 8(a))。水分含量过低, 淀粉颗粒的膨胀受限, 表现为竞争性吸水, 颗粒膨胀不均匀, 大颗粒先吸水膨胀并失去结晶结构, 小颗粒不容易吸水仍保持完好的颗粒形态(见图 7(d)、图 7(e))。当粉水比为3/10或5/10时, 淀粉颗粒中的偏光十字几乎完全消失(见图 6(b)、图 6(c)), 而且颗粒整体膨胀适度, 存在一定程度的溶胀现象, 颗粒丧失自身的完整性(见图 7(b)、图 7(c)和图 8(b)、图 8(c))。
3.2 粒度分布
在进行粒度分析时, 采用无水乙醇作为分散剂, 因为乙醇可以稳定淀粉的结晶结构[17], 使高压处理后的淀粉颗粒较为稳定。而如果采用水作为分散剂, 对于结晶结构完全破坏或部分破坏的淀粉颗粒, 水作为塑化剂的作用更加明显, 颗粒在其作用下发生明显膨胀, 从而影响HHP处理后颗粒粒度分布的真实性。
随着粉水比的增大, 水分含量减少, 两种淀粉颗粒的平均粒径均逐渐减小。糯玉米淀粉颗粒的平均粒径从53.41±4.2 μm(对应粉水比1/10)下降到29.05±0.51 μm(对应粉水比1), 木薯淀粉颗粒的平均粒径从33.71±0.40 μm(对应粉水比1/10)下降到18.43±2.79 μm(对应粉水比1), 如表 1所示。颗粒粒径减小会降低微粒的沉降速率, 因此淀粉颗粒的粒径大小是考察体系稳定性的一个重要因素。粒径小的产品稳定性相对较高。综合考虑糊化和反应效率两个因素, 水分太高或太低都不利于结晶结构的破坏, 在粉水比为1/10、7/10及1的样品中, 结晶结构没有完全破坏, 而粉水比为3/10和5/10的样品能在HHP处理后发生适度膨胀, 且具有适当的颗粒粒度, 作为添加剂能够保证产品性能的稳定性, 不易发生沉淀或凝聚。
表 1 不同粉水比的糯玉米及木薯淀粉HHP处理后颗粒的粒径分布Table 1. Parameters of particle size distribution for HHP modified waxy maize and tapioca starch with different starch-water ratiosMaterial Starch-water
ratioParticle size distribution/(%) Mean/(μm) dspan CV/(%) DS/(%) <10 μm 10~20 μm 20~40 μm 40~70 μm >70 μm Waxy
maize starch1/10 8.71±0.70ab 13.99±15.15ab 26.60±1.27b 21.95±0.64ab 27.60±2.97e 53.41±4.24c 2.80±0.04c 81.25±0.21b 21.55±0.32bc 3/10 9.57±2.02ab 14.83±4.20a 28.05±7.00ba 24.20±0.14b 23.30±5.29f 48.71±6.96e 2.34±0.13abc 75.15±0.92ab 36.69±7.95abc 5/10 11.20±1.56bcd 18.60±0.57bc 31.75±1.06c 24.00±2.26ab 14.50±0.85c 38.70±0.88c 2.30±0.21abc 74.30±5.94ab 11.15±8.89abc 7/10 13.95±1.77de 20.90±2.55c 36.40±0.99de 20.70±3.95ab 8.08±0.65b 32.85±0.80ab 2.15±0.26ab 78.15±9.55ab 25.65±2.51c 1 14.95±0.92e 21.95±1.91c 38.10±0.85e 21.45±2.76ab 3.54±0.80a 29.05±0.51a 1.92±0.10a 67.30±5.52a 0.68±8.25a Tapioca
starch1/10 16.35±0.92ab 19.20±0.00ab 31.80±1.41a 22.10±0.71d 10.53±1.23ab 33.71±0.40c 2.34±0.14a 74.70±1.98a 6.56±2.83a 3/10 16.85±1.20ab 20.25±1.48abc 31.25±0.07a 20.80±1.70cd 10.85±1.60ab 33.46±1.48b 2.46±0.10a 77.55±3.04a 10.63±4.33a 5/10 21.45±0.49ab 26.20±1.84bcd 30.70±2.40a 16.85±1.34bcd 4.61±3.32a 26.55±2.93ab 2.46±0.27a 78.20±5.66a 11.56±0.08a 7/10 25.50±0.85b 32.20±0.71de 25.90±0.42a 12.00±0.28abc 4.40±1.41a 23.30±1.33ab 2.77±0.04a 88.30±4.95a 25.97±7.06a 1 29.40±1.13b 40.30±4.81e 22.25±1.20a 6.20±2.26a 1.87±2.64a 18.43±2.79a 2.47±0.44a 86.00±22.63 22.68±3.27a Note:(1) All values are mean values of triplicate determinations±standard deviations;
(2) Values sharing the same uppercase letter within a line are not significantly different(P<0.05);
(3) Mean:De Brouckere diameter;dspan:Measurement of the width of size distribution, the narrower the distribution, the smaller the dspan is; CV:Volumetric concentration; DS:Swelling degree,DS=(CV-CV Native)/CV Native.3.3 晶体结构
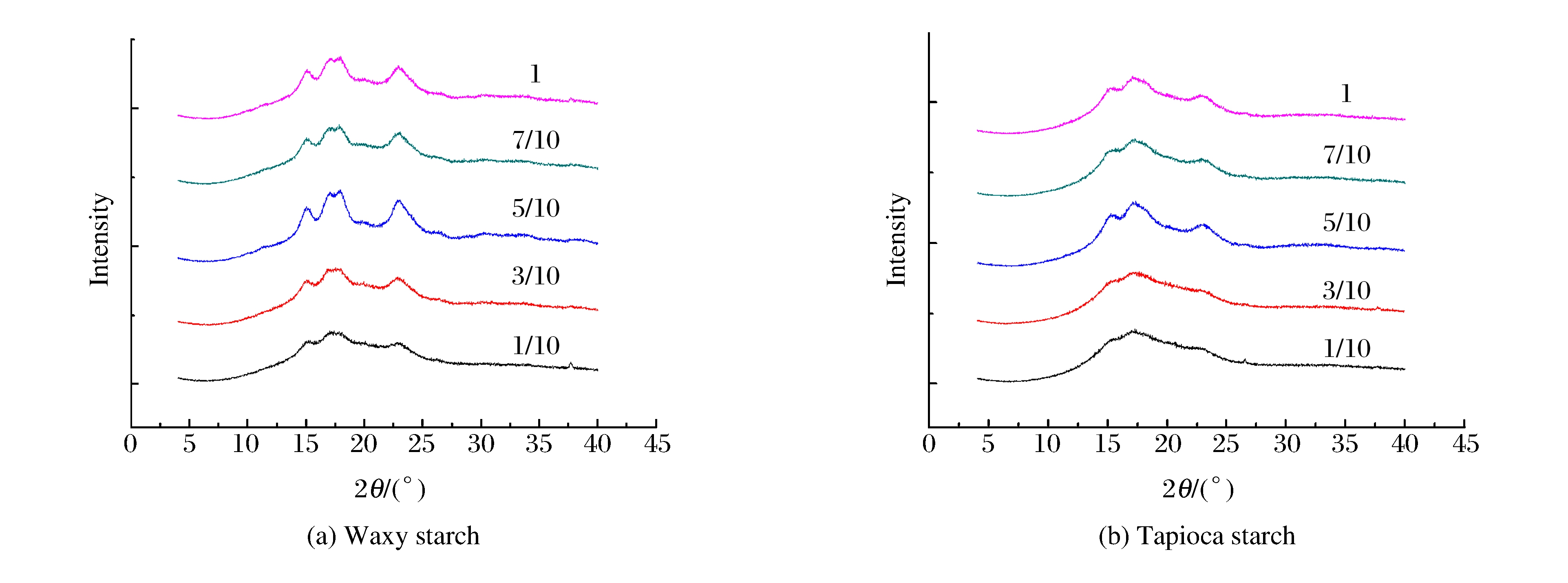
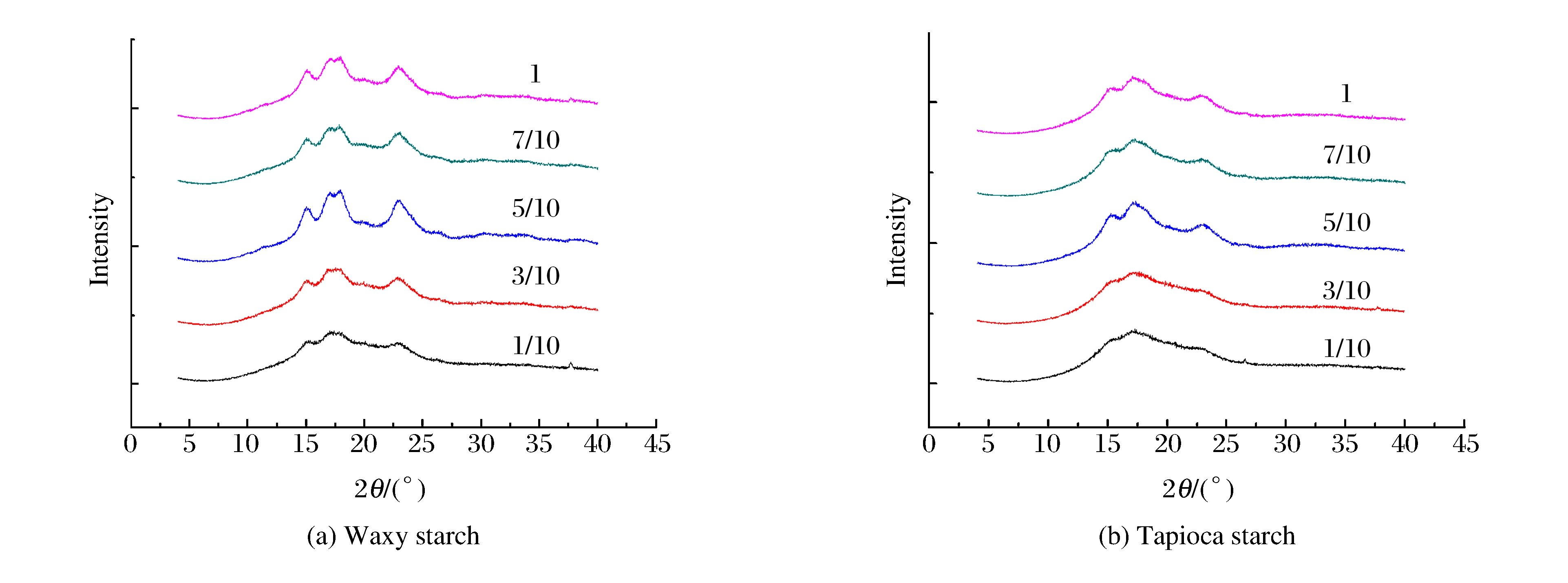
图 9(a)是不同粉水比的糯玉米淀粉样品在600 MPa高静压处理后的X射线衍射图谱。不同水分含量条件下, 糯玉米淀粉的晶型结构不变, 仍为A型, 但衍射峰强度明显不同。糯玉米淀粉经600 MPa高静压处理后, 结晶结构完全消失, 颗粒吸水膨胀, 崩解破裂后的淀粉颗粒迅速发生重结晶[14-15]。水分含量对淀粉重结晶的影响非常显著(P < 0.05)。粉水比为1/10时, 样品的X射线衍射曲线仍为典型的非晶弥散峰(见图 9(a)), 相对结晶度为0(见表 2), 说明经600 MPa处理后, 该样品的重结晶程度很低, 因为过高的水分含量会抑制淀粉分子的交联缠绕和结晶重排[18]。水分含量较高时, 虽然淀粉分子链迁移速率提高, 但由于淀粉浓度降低, 支链淀粉交联缠绕, 聚合为有序结构的机会减少。随着水分含量减少, 结晶度开始增加, X射线衍射强度增加。当粉水比为5/10时, 重结晶程度最高。当水分含量继续减少, 粉水比达到7/10甚至1时, X射线衍射强度减弱, 结晶度下降。这是由于水分含量较低时, 淀粉分子链迁移困难。因此, 水分含量过高和过低都会抑制淀粉分子的交联缠绕和结晶重排[18]。
表 2 不同粉水比的糯玉米和木薯淀粉在600 MPa HHP处理后的X射线衍射参数Table 2. X-ray powder diffraction parameters for 600MPa HHP modified waxy maize and tapioca starch with different stach-water ratiosMaterial Stach-water
ratioHalf peak height Peak area Total area Relative crystallinity/
(%)15.0° 17.2° 17.8° 22.9° Waxy
maize1/10 2 293 2 996 3 232 2 307 0.33 20 106 0.00±0.00a 3/10 1 511 835 2 067 841 7 247 27 937 14.39±0.12b 5/10 1 735 2 182 2 042 2 351 340 735 990 797 34.39±0.08d 7/10 1 951 2 936 2 020 2 411 215 566 859 177 25.09±0.03c 1 2 039 2 429 2 017 2 406 274 046 1 045 979 26.20±0.04d Material Starch-water
ratioHalf peak height Peak area Total area Relative crystallinity/
(%)15.3° 17.2° 17.8° Tapioca
starch1/10 423.5 1 019 1 262 17.12 400 624 0.00±0.00a 3/10 847.5 1 817 775 115 877 436 0.01±0.15a 5/10 258 397 74 7 728 39 618 0.00±0.77a 7/10 1 992 2 373 1 837 270 048 580 312 40.54±0.08b 1 1 860 2 208 1 741 292 510 615 941 47.49±0.01c Note:The relative crystallinity values were triplicate determinations±standard deviations. 木薯淀粉经600 MPa处理后, 发生晶体解体[15]。由图 9(b)可见, 水分含量越高, 淀粉结晶度越低。当粉水比为1/10、3/10及5/10时, 相对结晶度都为0(见表 2), X射线衍射峰为弥散峰(见图 9(b)), 说明水分使微晶结构和微晶片层之间的无定型区域同时遭到破坏。而当淀粉颗粒中含水量较低(如粉水比为7/10或1)时, 结晶度比高压处理前的原淀粉结晶度还高(P < 0.05, 见表 2), 主要原因是当水分含量少时, 淀粉颗粒吸水膨胀受到两个因素限制, 一个是水分含量, 另一个是高静压力的作用。高静压力使一部分水进入淀粉颗粒内部, 被压入颗粒结晶区域, 从而导致结晶度增大。此外, 淀粉无定形区发生塑化作用, 导致颗粒中更多微晶结构的形成。
3.4 水分分布
当粉水比为3/10和5/10时, 糯玉米及木薯淀粉颗粒适度膨胀, 偏光十字完全消失, 性质稳定。此时, 糯玉米淀粉最容易发生重结晶, 木薯淀粉的结晶结构完全破坏。对该范围进行细分, 令粉水比分别为3/10、4/10和5/10, 分析经过HHP处理后, 各样品中水分的存在方式及数量, 并以此推测水分含量不同, 对糯玉米淀粉吸水膨胀后的重结晶过程, 及木薯淀粉结晶结构破坏过程的影响。
淀粉含有一定水分, 它以适当的数量, 定位、定向地存在于淀粉颗粒中。水分子的结合能力和流动性对淀粉的流变性质、稳定性、质构、外观以及对腐败的敏感性有很大影响。淀粉质原料和产品在加工、贮藏和运输等过程中, 内部的水分含量和分布状态经常会发生改变, 这也是导致原料稳定性下降、产品品质降低的主要原因之一。低场核磁共振广泛应用于生物体系中结合水的研究, 一方面因为它对被检测物无破坏性, 另一方面, 它可以测定能反映水分子流动性的氢核的纵向弛豫时间(原子核从激化状态回复到平衡排列状态的过程称为弛豫过程, 其所需时间为弛豫时间)t1和横向弛豫时间t2。当水和底物紧密结合时, 它高度固定, t2较低; 而游离水流动性好, t2较大。从而得知水分结合的方式及程度[19]。
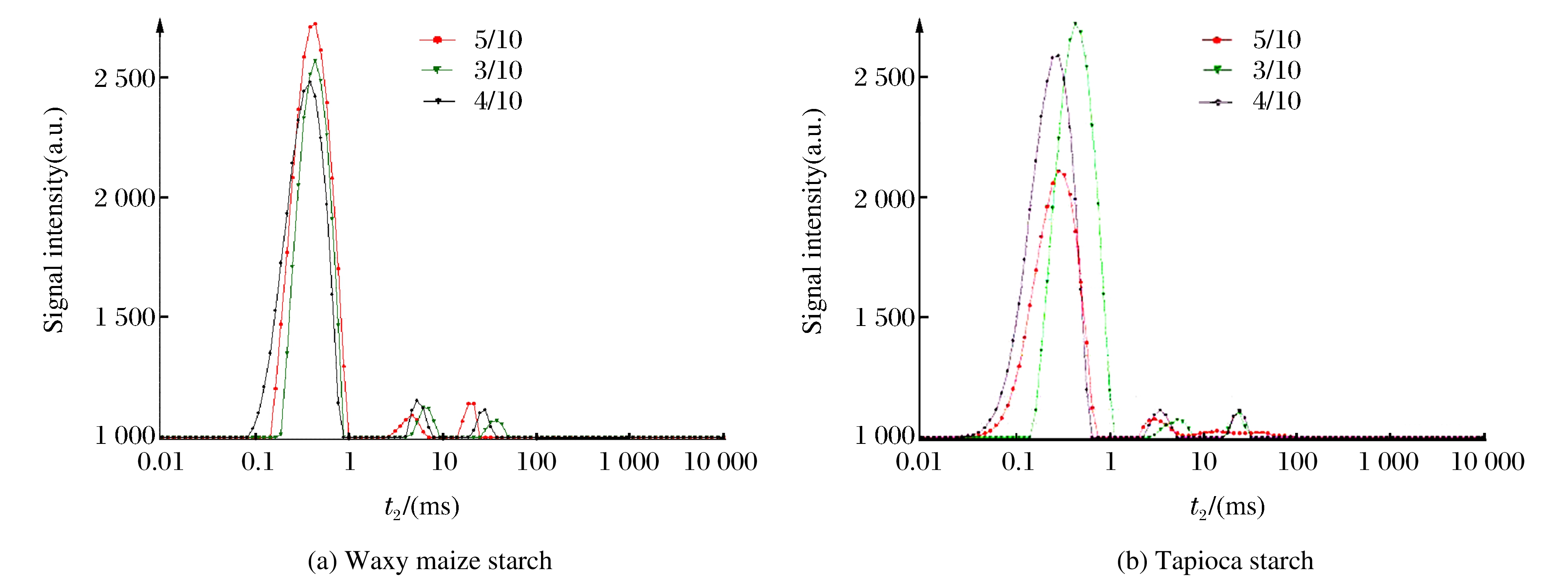
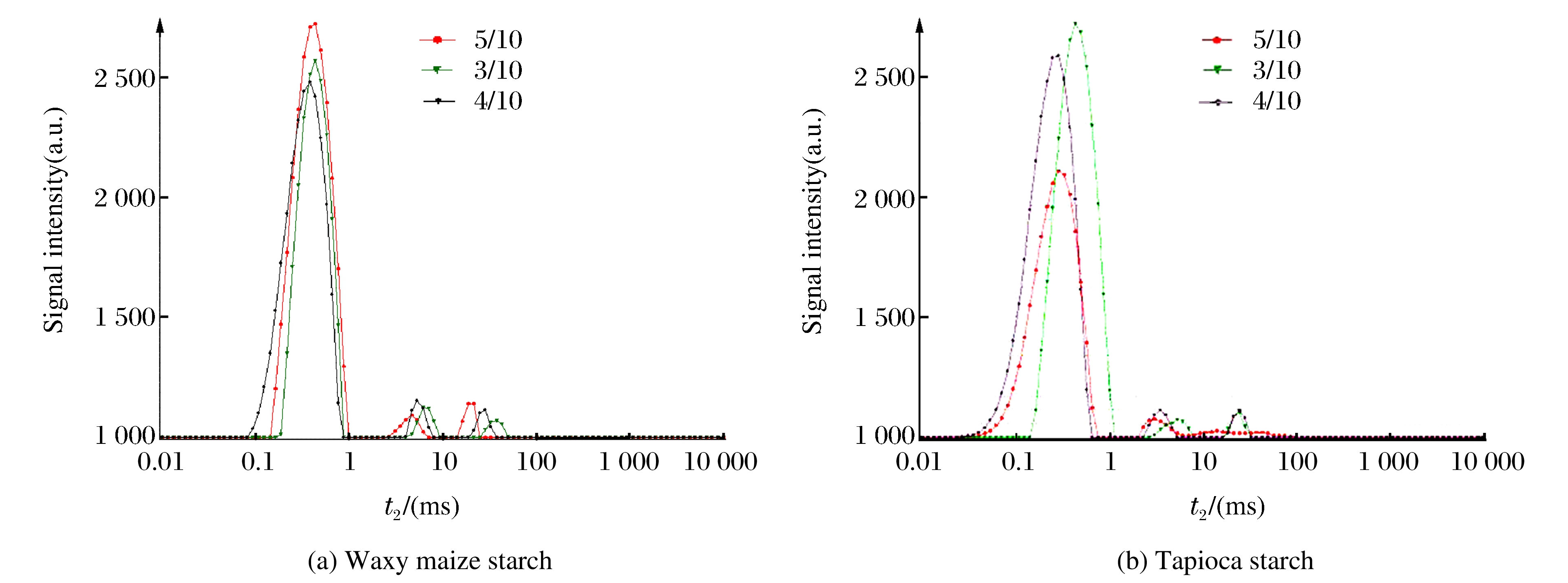
图 10是不同粉水比的糯玉米和木薯淀粉的低场核磁图谱, 横坐标表示横向弛豫时间t2, 纵坐标表示信号强度; 出现的3个峰, 其对应的t2从左向右分别记为t21、t22、t23, 说明淀粉内部至少存在3种流动性不同的水。由图 10(a)可以看出, 糯玉米淀粉t2的变化范围在0.1~100 ms之间。随着t2的增加, 淀粉内部水分的结合力逐渐减弱, t21∈[0.1, 1 ], 对应于淀粉中的活性较小的水, 流动性差, 为淀粉分子内部的结合水; t22∈[1, 10], 大于t21, 为不易流动的水; t23∈[10, 100], 为易流动的水。t21对应的信号强度远大于t22和t23, 因此HHP处理使淀粉中的水大都以结合态形式存在, 水分被牢牢地锁紧在淀粉颗粒中。粉水比为5/10的样品中, 结合水含量最高, 且各个信号峰值对应的t2值最小, 说明HHP处理后, 5/10的糯玉米淀粉中水分结合得最牢固, 流动性低; 且水分参与重结晶, 形成晶体结构的一部分。
由图 10(b)可知, 木薯淀粉的t2值范围为0.01~100 ms, 且各个峰所对应的t2值比糯玉米淀粉的小, 说明HHP处理后木薯淀粉内的水分固定得更牢固。且对于粉水比5/10的样品, t23峰几乎看不到, 可以认为5/10的木薯淀粉中几乎不含有自由水分。3/10的样品t2值最大, 说明水分的流动性最大; 但代表结合水的峰面积最大, 说明结合水所占比例最多。
4. 结论与展望
水分对高静压处理淀粉的糊化及重结晶有重要影响。适度水分含量的淀粉颗粒较容易在HHP处理下发生结晶解体及溶胀现象。粉水比为3/10和5/10的样品具有适度的水分含量。在该水分含量下, 糯玉米淀粉发生结晶解体后吸水膨胀, 不同样品的重结晶程度4/10粉水比 > 3/10粉水比 > 5/10粉水比; 木薯淀粉颗粒结晶结构完全消失, 其结晶破坏程度为3/10粉水比 > 4/10粉水比 > 5/10粉水比。随着水分含量的增加, 糯玉米及木薯淀粉的粒度逐渐增大。干燥后淀粉中的水分主要以结合水的形式存在, 且水分参与重结晶。
目前, 高压导致不同类型淀粉水分的竞争性吸收机制仍然值得继续深入研究。
-
表 1 不同粉水比的糯玉米及木薯淀粉HHP处理后颗粒的粒径分布
Table 1. Parameters of particle size distribution for HHP modified waxy maize and tapioca starch with different starch-water ratios
Material Starch-water
ratioParticle size distribution/(%) Mean/(μm) dspan CV/(%) DS/(%) <10 μm 10~20 μm 20~40 μm 40~70 μm >70 μm Waxy
maize starch1/10 8.71±0.70ab 13.99±15.15ab 26.60±1.27b 21.95±0.64ab 27.60±2.97e 53.41±4.24c 2.80±0.04c 81.25±0.21b 21.55±0.32bc 3/10 9.57±2.02ab 14.83±4.20a 28.05±7.00ba 24.20±0.14b 23.30±5.29f 48.71±6.96e 2.34±0.13abc 75.15±0.92ab 36.69±7.95abc 5/10 11.20±1.56bcd 18.60±0.57bc 31.75±1.06c 24.00±2.26ab 14.50±0.85c 38.70±0.88c 2.30±0.21abc 74.30±5.94ab 11.15±8.89abc 7/10 13.95±1.77de 20.90±2.55c 36.40±0.99de 20.70±3.95ab 8.08±0.65b 32.85±0.80ab 2.15±0.26ab 78.15±9.55ab 25.65±2.51c 1 14.95±0.92e 21.95±1.91c 38.10±0.85e 21.45±2.76ab 3.54±0.80a 29.05±0.51a 1.92±0.10a 67.30±5.52a 0.68±8.25a Tapioca
starch1/10 16.35±0.92ab 19.20±0.00ab 31.80±1.41a 22.10±0.71d 10.53±1.23ab 33.71±0.40c 2.34±0.14a 74.70±1.98a 6.56±2.83a 3/10 16.85±1.20ab 20.25±1.48abc 31.25±0.07a 20.80±1.70cd 10.85±1.60ab 33.46±1.48b 2.46±0.10a 77.55±3.04a 10.63±4.33a 5/10 21.45±0.49ab 26.20±1.84bcd 30.70±2.40a 16.85±1.34bcd 4.61±3.32a 26.55±2.93ab 2.46±0.27a 78.20±5.66a 11.56±0.08a 7/10 25.50±0.85b 32.20±0.71de 25.90±0.42a 12.00±0.28abc 4.40±1.41a 23.30±1.33ab 2.77±0.04a 88.30±4.95a 25.97±7.06a 1 29.40±1.13b 40.30±4.81e 22.25±1.20a 6.20±2.26a 1.87±2.64a 18.43±2.79a 2.47±0.44a 86.00±22.63 22.68±3.27a Note:(1) All values are mean values of triplicate determinations±standard deviations;
(2) Values sharing the same uppercase letter within a line are not significantly different(P<0.05);
(3) Mean:De Brouckere diameter;dspan:Measurement of the width of size distribution, the narrower the distribution, the smaller the dspan is; CV:Volumetric concentration; DS:Swelling degree,DS=(CV-CV Native)/CV Native.表 2 不同粉水比的糯玉米和木薯淀粉在600 MPa HHP处理后的X射线衍射参数
Table 2. X-ray powder diffraction parameters for 600MPa HHP modified waxy maize and tapioca starch with different stach-water ratios
Material Stach-water
ratioHalf peak height Peak area Total area Relative crystallinity/
(%)15.0° 17.2° 17.8° 22.9° Waxy
maize1/10 2 293 2 996 3 232 2 307 0.33 20 106 0.00±0.00a 3/10 1 511 835 2 067 841 7 247 27 937 14.39±0.12b 5/10 1 735 2 182 2 042 2 351 340 735 990 797 34.39±0.08d 7/10 1 951 2 936 2 020 2 411 215 566 859 177 25.09±0.03c 1 2 039 2 429 2 017 2 406 274 046 1 045 979 26.20±0.04d Material Starch-water
ratioHalf peak height Peak area Total area Relative crystallinity/
(%)15.3° 17.2° 17.8° Tapioca
starch1/10 423.5 1 019 1 262 17.12 400 624 0.00±0.00a 3/10 847.5 1 817 775 115 877 436 0.01±0.15a 5/10 258 397 74 7 728 39 618 0.00±0.77a 7/10 1 992 2 373 1 837 270 048 580 312 40.54±0.08b 1 1 860 2 208 1 741 292 510 615 941 47.49±0.01c Note:The relative crystallinity values were triplicate determinations±standard deviations. -
[1] 王标诗, 李汴生, 曾庆孝, 等.热压协同处理对接种于鸡腿菇中的细菌芽孢灭活效果的影响[J].高压物理学报, 2010, 24(2): 136-142. http://www.cnki.com.cn/Article/CJFDTotal-GYWL201002011.htmWang B S, Li B S, Zeng Q X, et al. Inactivation effects of coprinus comatus inoculated with bacterial spores by high-pressure thermal processing[J]. Chinese Journal of High Pressure Physics, 2010, 24(2): 136-142. (in Chinese) http://www.cnki.com.cn/Article/CJFDTotal-GYWL201002011.htm [2] Shi W G, Wu H J, Zhou G Q, et al. Molecular analysis of stable mutagenesis in cucumber induced by high hydrostatic pressure[J]. Chinese Journal of High Pressure Physics, 2011, 25(4): 379-384. http://www.researchgate.net/publication/286043786_Molecular_analysis_of_stable_mutagenesis_in_cucumber_induced_by_high_hydrostatic_pressure [3] Farkas D F, Hoover D G. High pressure processing: Kinetics of microbial inactivation for alternative food processing technologies[J]. J Food Sci, 2000, 65(Suppl): 47-64. http://www.mendeley.com/catalog/kinetics-microbial-inactivation-alternative-food-processing-technologies-high/ [4] Meyer R S, Cooper K L, Knorr D, et al. High-pressure sterilization of foods[J]. Food Technol, 2000, 54(11): 67-72. [5] Butz P, Tauscher B. Emerging technologies: Chemical aspects[J]. Food Res Int, 2002, 35(2/3): 279-284. http://www.sciencedirect.com/science/article/pii/S0963996901001971 [6] 刘培玲, 张甫生, 白云飞, 等.高静压对淀粉结构及糊化性质的影响[J].高压物理学报, 2010, 24(6): 472-480. http://www.cqvip.com/QK/96553X/201006/37139327.htmlLiu P L, Zhang F S, Bai Y F, et al. Effect of high hydrostatic pressure on starch structure and gelatinization[J]. Chinese Journal of High Pressure Physics, 2010, 24(6): 472-480. (in Chinese) http://www.cqvip.com/QK/96553X/201006/37139327.html [7] Stute R, Klingler R W, Boguslawski S, et al. Effects of high pressures treatment on starches[J]. Starch-Stärke, 1996, 48(11/12): 399-408. http://adsabs.harvard.edu/abs/1996EEEV...48..399S [8] 张力田.碳水化合物化学[M].北京: 轻工业出版社, 1988.Zhang L T. Carbohydrate Chemistry[M]. Beijing: China Light Industry Press, 1988. (in Chinese) [9] Buckow R, Heinz V, Knorr D. High pressure phase transition kinetics of maize starch[J]. J Food Eng, 2007, 81(2): 469-475. doi: 10.1016/j.jfoodeng.2006.11.027 [10] Vainionpää J, Forssell P, Virtanen T. High-pressure gelatinization of barley starch at low moisture levels and elevated temperature[J]. Starch-Stärke, 1993, 45(1): 19-24. doi: 10.1002/star.19930450106 [11] Orlowska M, Utzig E, Randzio S L. Thermogravimetric study of water state in wheat starch gels obtained under high pressures[J]. Ann NY Acad Sci, 2010, 1189: 55-61. doi: 10.1111/j.1749-6632.2009.05200.x [12] Umeki K, Kainuma K. Fine structure of Nägeli amylodextrin obtained by acid treatment of defatted waxy-maize starch-structural evidence to support the double-helix hypothesis[J]. Carbohyd Res, 1981, 96(2): 143-159. doi: 10.1016/S0008-6215(00)81866-2 [13] Perry P A, Donald A M. SANS study of the distribution of water within starch granules[J]. Int J Bio Macromol, 2000, 28(1): 31-39. doi: 10.1016/S0141-8130(00)00143-4 [14] 刘培玲, 任瑞林, 包亚莉, 等.高静压物理变性处理糯玉米淀粉的糊化及重结晶机理研究[J].高压物理学报, 2014, 28(4): 247-256. http://www.cqvip.com/QK/96553X/20142/663190621.htmlLiu P L, Ren R L, Bao Y L, et al. Effect of high hydrostatic pressure as a physical modification method on waxy maize starch gelatinization and retrogradation[J]. Chinese Journal of High Pressure Physics, 2014, 28(4): 247-256. (in Chinese) http://www.cqvip.com/QK/96553X/20142/663190621.html [15] 刘培玲, 沈群, 胡小松, 等. X射线衍射法研究不同类型淀粉高静压处理后晶体结构的变化[J].光谱与光谱分析, 2012, 32(9): 2579-2582. http://d.wanfangdata.com.cn/Periodical/gpxygpfx201209060Liu P L, Shen Q, Hu X S, et al. X-ray diffraction study of high hydrostatic pressure on crystalline structure different type starches[J]. Spectroscopy and Spectral Analysis, 2012, 32(9): 2579-2582. (in Chinese) http://d.wanfangdata.com.cn/Periodical/gpxygpfx201209060 [16] Miles M J, Morris V J, Orford P D, et al. The roles of amylose and amylopectin in the gelation and retrogradation of starch[J]. Carbohyd Res, 1985, 135(2): 271-281. doi: 10.1016/S0008-6215(00)90778-X [17] Katopo H, Song Y, Jane J. Effect and mechanism of ultrahigh hydrostatic pressure on the structure and properties of starches[J]. Carbohyd Polym, 2002, 47(3): 233-244. doi: 10.1016/S0144-8617(01)00168-0 [18] Fu Z Q, Wang L J, Li D, et al. Effects of high-pressure homogenization on the properties of starch-plasticizer dispersions and their films[J]. Carbohyd Polym, 2011, 86(1): 202-207. doi: 10.1016/j.carbpol.2011.04.032 [19] 邵小龙, 李云飞.用低场核磁共振研究烫漂对甜玉米水分布和状态影响[J].农业工程学报, 2009, 25(10): 302-306. http://www.cnki.com.cn/Article/CJFDTotal-NYGU200910056.htmShao X L, Li Y F. Effects of blanching on water distribution and water status in sweet corn investigated by using MRI and NMR[J]. Transactions of the CSAE, 2009, 25(10): 302-306. (in Chinese) http://www.cnki.com.cn/Article/CJFDTotal-NYGU200910056.htm -








 下载:
下载:










 下载:
下载: