Applications of High-Pressure Solution Device for Synchrotron Radiation Small Angle X-Ray Scattering Method
-
摘要: 高压作为一种重要的热力学变量,可用于引发软物质系统中的各种结构变化。小角X射线散射具有高空间分辨能力,可用于蛋白质折叠动力学、核酸结构稳定机制研究,在生命科学领域具有广阔的应用前景。然而,目前国内尚缺少用于高压溶液散射的专用装置,为此,在上海光源BL19U2线站设计开发了一种专用于溶液X射线散射的高压原位样品装置和手动加压系统,实现了在0.1~250 MPa范围内静水压测量。该装置可实现X射线窗口在整个测量过程中保留在原位,有助于准确扣除背景散射,实现高信噪比测量,为食品科学、药理学、结构生物学等研究领域提供重要的研究平台。Abstract: High pressure is one of the fundamental thermodynamic parameters, which can induce the structural changes in soft matter systems. By combining the spatial resolution of small-angle X-ray scattering (SAXS), this technique can be employed to explore the dynamics of protein folding and the mechanisms of nucleic acid structural stability. Moreover, it has promising and broad applications in the field of life sciences. Currently, the specialized equipment for high-pressure solution scattering is still lacking in China. For this purpose, a high-pressure in-situ sample device and a manual pressurization system for specialized solution X-ray scattering have been developed at BL19U2 beamline at SSRF, which can complete the hydrostatic pressure measurements from 0.1 to 250 MPa. More important, the apparatus can keep the X-ray window in the same place throughout the experiment, which can help to subtract the accurate background scattering and achieve the measurements with high signal-to-noise ratio. This will provide a valuable research platform for wide range of areas, including food science, pharmacology, and structural biology.
-
高压能够影响生物大分子的结构和功能[1],例如,压力可以导致蛋白质折叠和展开[2]、触发脂质膜的形成[3]以及影响DNA和RNA的构象[4–5]等。小角X射线散射(small-angle X-ray scattering,SAXS)是在纳米尺度研究生物大分子结构特性的一种有效方法,由SAXS数据可以构建三维低分辨率模型[6]。利用高压引起的构象变化,结合小角X射线散射(SAXS)的高空间分辨能力,可以研究这些系统的不平衡变化,进而研究蛋白质折叠动力学、核酸的结构稳定机制,在生命科学、医药[7]和食品科学[8]等领域具有广阔的应用前景。
利用同步辐射装置开展高压实验研究具有独特的优势[9–12]。同步辐射具有光准直性好、光斑尺寸小、通量高的特点,再结合高压原位技术,是研究极端条件下物质结构的有力手段。因此,国内外同步辐射装置均建设了专用的高压线站,如北京同步辐射装置(BSRF)的4W2线站[12]、美国先进光源(Advanced Light Source,ALS)的12.2.2线站[11]、德国电子同步加速器(DESY)的PETRA Ⅲ极端条件线站P02.2[13]、日本SPring-8光源的高压单晶衍射线站BL10XU[14]等。然而,利用同步辐射SAXS方法进行高压溶液实验却存在技术困难。首先,SAXS信号分布在小角度范围内,为了保证信号的分辨率,样品到探测器之间的距离需要足够远,不便于在专用线站开展SAXS实验;其次,对于溶液散射而言,其散射强度比固态样品更弱,对背底的一致性要求更高。传统金刚石对顶压砧(diamond anvil cell,DAC) 技术中使用的单晶金刚石存在衍射条纹,更换样品需要将压机拆下,无法保证散射背底的一致性。因此,需要开发专用的高压溶液SAXS装置。
国际上已开发出专用的溶液散射压腔用于同步辐射装置SAXS线站。1997年,奥地利科学家Pressl等[15]报道了一种适用于同步辐射SAXS实验的高压溶液样品装置;随后,在美国阿贡先进光源(APS)、欧洲同步辐射光源(ESRF)以及美国康耐尔同步加速器光源(CHESS) 开展了相关装置的研发和应用[16];2010年,英国钻石光源(Diamond)在此基础上设计了一款可以温度跳变(时间尺度为毫秒)的原位样品装置[17]。这些专用高压溶液样品腔的发展支持了用户在蛋白折叠[18]、脂质体相变[19–20]等方面的研究。目前,国内还没有用于溶液SAXS的专用高压样品实验装置,限制了相关领域的发展。由于BL19U2生物小角散射线站具有光通量高、发散角小的特点,因此非常适合开展软物质动力学过程研究[21]。BL19U2散射团队基于对国内相关实验装置的认识,依托上海同步辐射装置,开发一种溶液SAXS专用高压原位样品装置,以期为软物质科学(如食品科学、药理学、结构生物学等)研究领域提供一个新的高压溶液散射实验平台。
1. 高压溶液散射装置
1.1 高压溶液散射压腔设计
针对生物大分子溶液散射的实际需求,设计压腔时主要考虑以下几点:(1) 生物大分子的大尺度结构变化主要来源于非共价相互作用,这类相互作用在高压下更易被压缩,几百兆帕就足以引起构象上的变化;(2) 以水作为传压介质,常温下纯水在约670 MPa压力处固化,因此将压力上限设定在500 MPa;(3) 考虑到BL19U2线站光束线的聚焦光斑尺寸为330 μm(水平)× 50 μm(垂直),通光口的尺寸应大于1 mm。
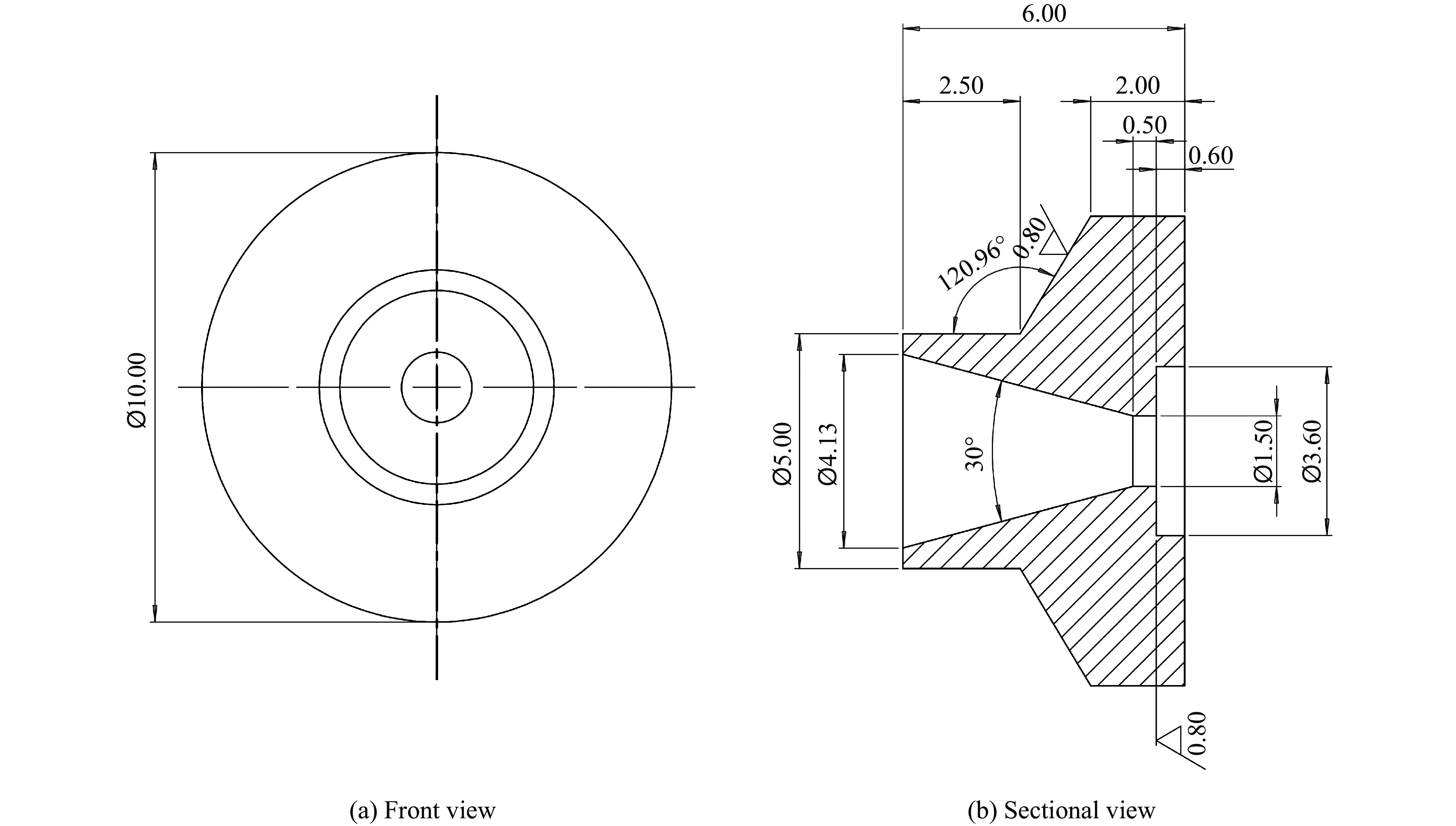
参考文献[15, 17]进行高压压腔设计。腔体形状为立方体,窗口与传压介质接口由3个彼此垂直的孔组成,如图1所示。设置一个沿X射线传输路径穿过整个腔体的通孔,将两端用金刚石材质的X射线窗口密封,金刚石窗口之间用定位环间隔,以免窗口之间压得过紧,而无法顺利换样;另一个通孔则由2个螺纹孔组成,两端分别接压力传感器和高压软管,面向样品处开有小孔,便于传压介质进出;顶部的孔则用于样品装载。样品池压腔材料选用V350合金钢,其屈服强度达到
2200 MPa,满足所需的强度要求。为了在腔体内获得足够高的压强,密封是关键的一环。窗口密封材料采用厚度为300 μm的Ⅱa型单晶金刚石片,该厚度的金刚石对13.5 keV下X射线透过率大于95%。窗口支架结构如图2所示,金刚石窗口通过高黏度环氧胶粘在支架底部。支架直径为10 mm,通光孔直径为1.5 mm,相对于BL19U2线站最大尺寸为300 μm的光斑而言,无需使用狭缝限制光斑尺寸,避免了通量损失。腔体出射窗口的有效张角2θ为30°,满足小角散射的测试要求。
窗口支架与腔体之间使用布里奇曼型密封件,当轴向压缩时,填充环沿径向变形,形成压缩密封。压力传感器、高压管路与腔体之间采用金属端面密封。对于高压管路与压腔的连接而言,将高压管穿过压紧螺母后与调整螺母螺纹连接,高压管前端锥面与样品池腔体通过挤压实现密封。样品窗口则采用“O”形密封圈封闭。这种静态密封在400 MPa以上或长时间的压力循环下开始恶化,密封性低于布里奇曼型。然而,这种密封件更易拆卸,且O形圈可以作为易损件更换,因此,此处采用O形圈密封以便于样品更换。
顶端的样品加载端口是该压腔的主要优势。在换样过程中,无需移除窗口。因此,在更换样品前后,X射线仍可保持照射在金刚石窗口的同一位置,不会使安装样品前获取的背景数据失效,并可方便地从实验数据中扣除。定位环沿X射线方向的厚度为2 mm,相当于形成了一个尺寸为2 mm的样品腔,样品支架刚好与腔体吻合,填充了腔体的大部分空间。样品由20 μm厚的聚酰亚胺胶带(X射线的透过率为99%)密封在支架的样品孔内,厚度为1.8 mm,孔的直径为2 mm,因此进行一次实验仅需要10 μL样品。
1.2 加压装置
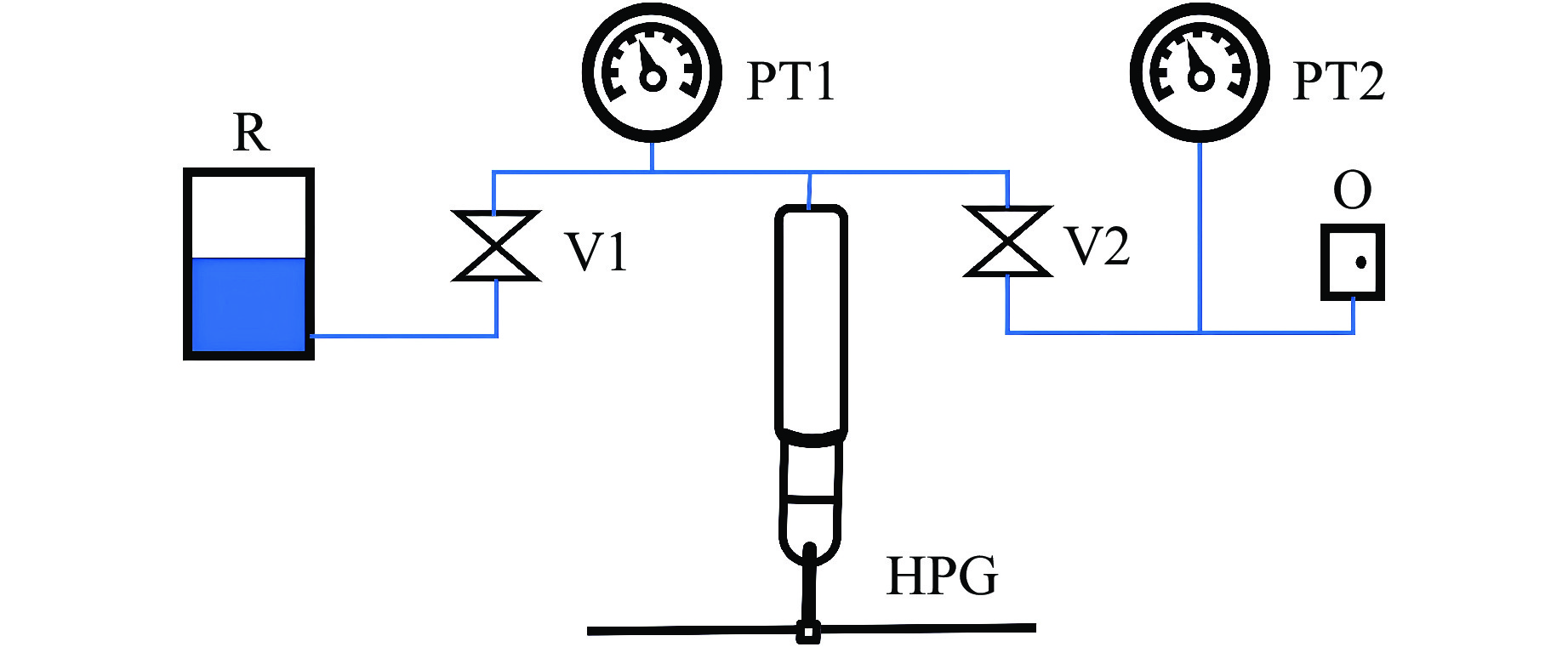
如图3所示,采用美国高压设备公司(High Pressure Equipment Company,HIP)生产的手动加压器(型号:37-5.75-60)以及针阀(型号:60-11 HF4)搭建了500 MPa 手动加压泵站,采用压力计显示压力,量程为500 MPa,精度为1%。通过快速接头连接高压泵站的出口和压腔。整个加压装置组装完成后集成在一块50 cm×45 cm 的钢板上。
 图 3 加压装置结构示意图(HPG为手动加压泵,V1和V2为高压针阀,PT1和PT2为压力表,R为传压介质存储罐,O为压力出口)Figure 3. Structural diagram of the pressurized device(HPG is the manual pressure pump; V1 and V2 are the high pressure needle valves; PT1 and PT2 are the pressure gauges; R is the pressure transmission medium storage tank; O is the pressure outlet.)
图 3 加压装置结构示意图(HPG为手动加压泵,V1和V2为高压针阀,PT1和PT2为压力表,R为传压介质存储罐,O为压力出口)Figure 3. Structural diagram of the pressurized device(HPG is the manual pressure pump; V1 and V2 are the high pressure needle valves; PT1 and PT2 are the pressure gauges; R is the pressure transmission medium storage tank; O is the pressure outlet.)通过高压管连接高压泵站与压腔,利用压紧螺母与调整螺母连接。调整螺母为左旋螺纹,因此,在将压紧螺母固定至压腔上时,可以自行调节高压管的行程;高压管前端锥面与样品池腔体通过挤压实现密封。
如图3所示,加压过程中,先关闭高压针阀V2,通过调节泵吸取液体;然后关闭高压针阀V1,放开V2,利用泵进行加压。若泵达到极限后,仍没有达到目标压力,则可以关闭V2,放开V1,重新吸取液体,再次进行加压。在加压调试过程中,整个系统运行正常,保压效果良好,重复操作显示250 MPa时压降小于0.02 MPa/min。当压力稍有下降时,轻轻转动手动泵手柄即可完成补压。
压力传感器(广州锐拓自动化科技有限公司生产,型号:LB1000)与压腔直接连接,量程范围为0~450 MPa,精度为0.5%。
2. 高压溶液散射实验
为了测试高压溶液散射压腔的性能,在上海光源BL19U2线站进行了原位SAXS测试。实验条件:X射线能量为12 keV,光斑尺寸为300 µm×50 µm。样品到探测器的距离为2.7 m,X射线探测器为瑞士DECTRIS公司的PILATUS 2M探测器,散射矢量范围为0.007 Å−1<q<0.400 Å−1,其中:q=4πsin θ/λ,2θ为散射角,X射线波长λ=1.033 Å。压腔通过专用夹具固定,夹具通过燕尾槽与底座相连,底座安装在1组二维电机上,可以进行上下左右调节,以使X射线通过窗口中部,如图4所示。更换样品时,取下压腔,与样品更换点的底座相连,拧开顶部螺栓即可换样。该过程中,电机的底座位置固定,且没有受到额外应力的作用,通过底座上的定位块可以保证窗口位置精度在1 µm内,与光斑尺寸相比,可忽略其位置变化。
 图 4 高压散射实验现场照片(加压泵站与压腔通过高压管线(蓝色)连接,压腔通过专用的底座安装于位移平台)Figure 4. Photos of high pressure scattering experiment (The pump station is connected with the pressure chamber through the high pressure pipeline (blue), and the pressure chamber is installed on the displacement platform through a special base.)
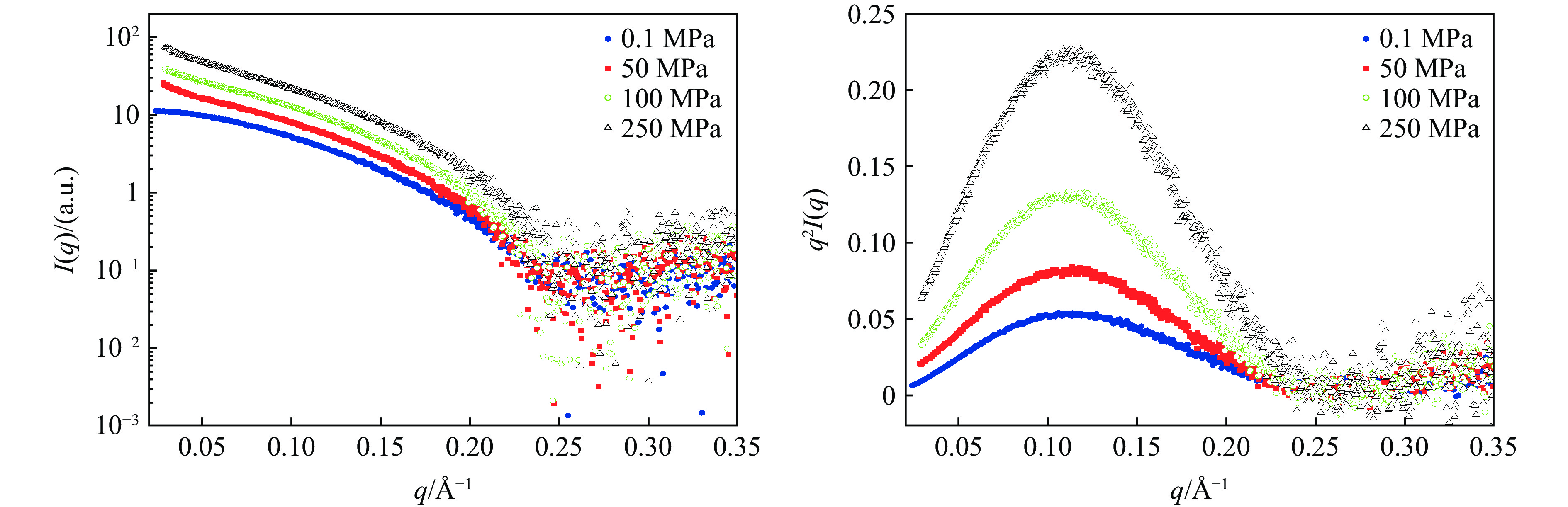
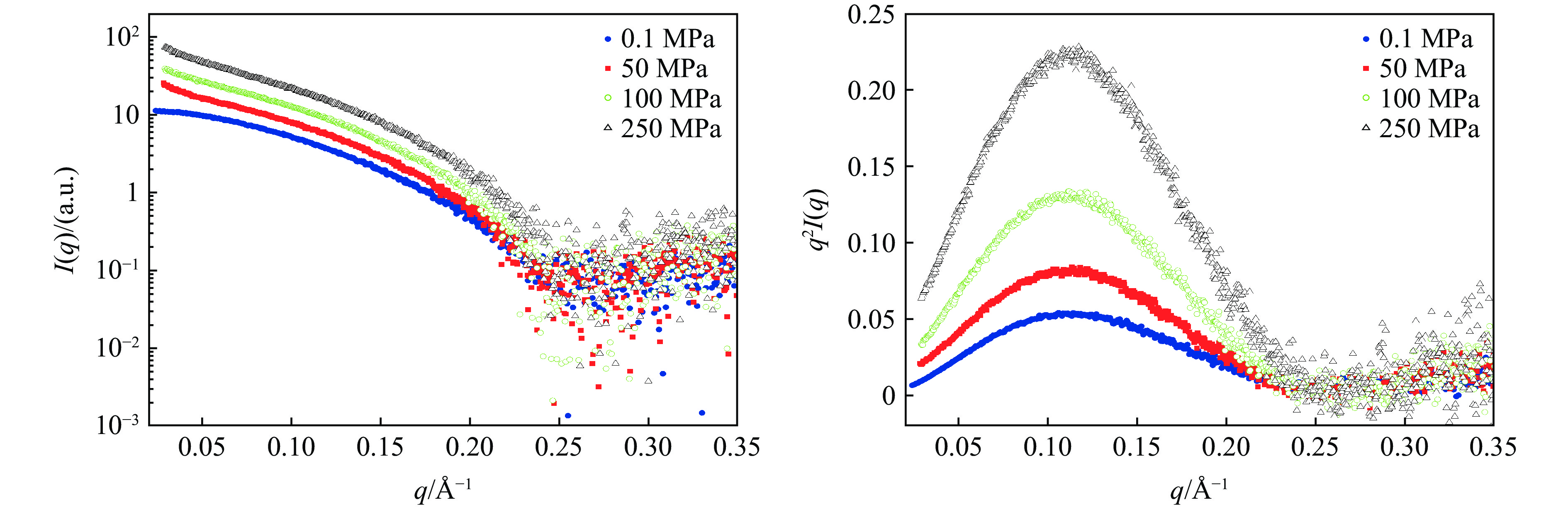
图 4 高压散射实验现场照片(加压泵站与压腔通过高压管线(蓝色)连接,压腔通过专用的底座安装于位移平台)Figure 4. Photos of high pressure scattering experiment (The pump station is connected with the pressure chamber through the high pressure pipeline (blue), and the pressure chamber is installed on the displacement platform through a special base.)为了验证实验装置的性能,采用标准样品溶菌酶进行测试。所使用的溶菌酶样品购自美国Sigma公司(CAS编号:12650-88-3,货号:62971-10G-F),缓冲液为磷酸盐缓冲液(PBS)。样品和缓冲液装入样品池后,两侧用Kapton胶带进行隔离,依靠薄膜变形进行压力传递。首先,加压到一定的压力,平衡 3 min后进行测量,曝光时间为1 s;然后,加压到另一个压力点,最终加压到250 MPa。实验结果如图5所示,其中I(q)为散射强度。从散射曲线(图5(a))可以看出,不同压力下的溶菌酶散射曲线变化趋势基本保持一致,这在Kratky图(图5(b))中也得到了证实,不同压力下的蛋白质基本维持球状结构,没有完全展开。上述结果与文献[22]的报道相符。Ortore等[22]通过小角X射线散射研究发现,溶菌酶在高达150 MPa的压力下完全保持球状结构。这些结果都证明了溶菌酶在压力下的超高稳定性。
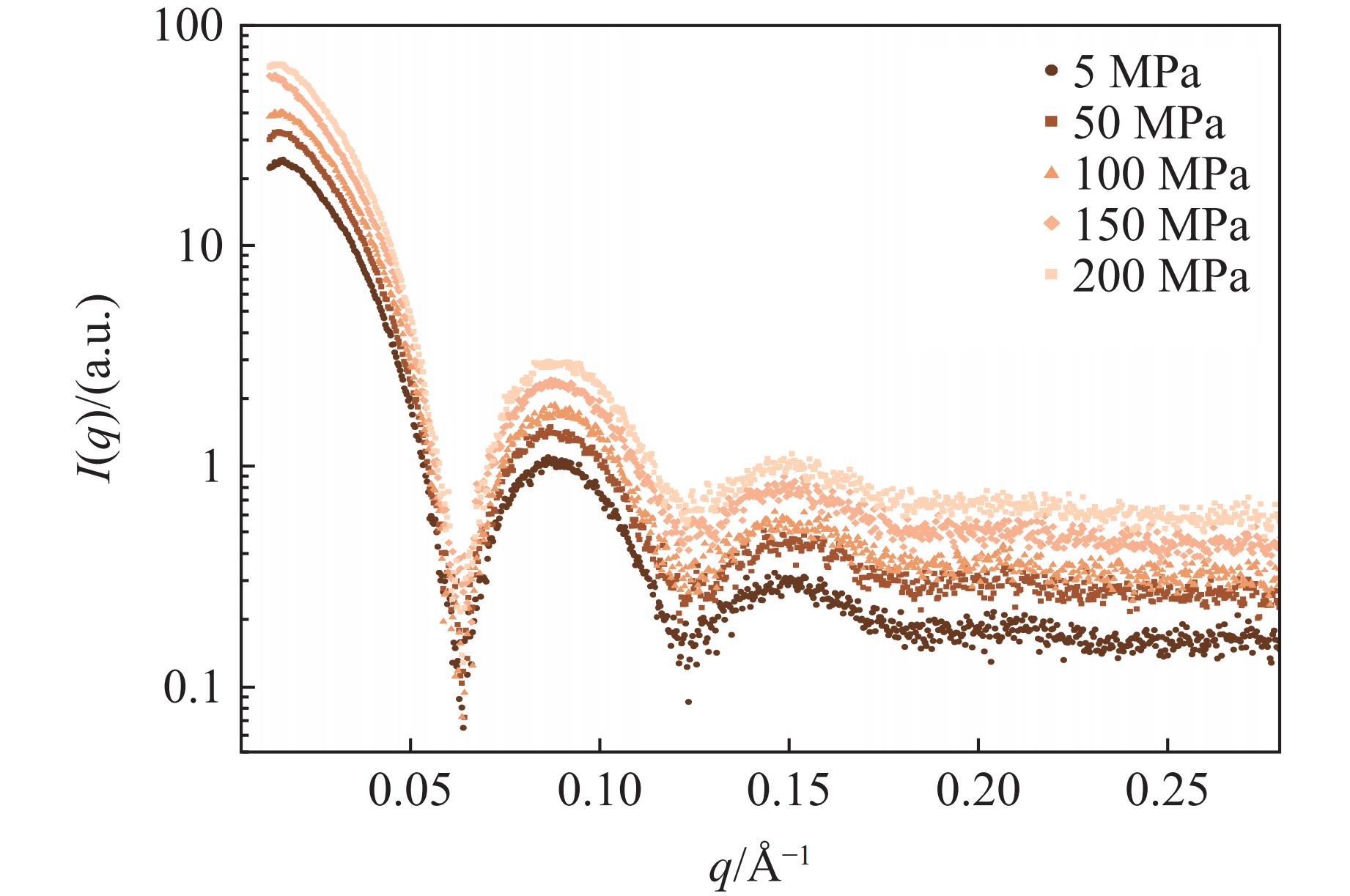
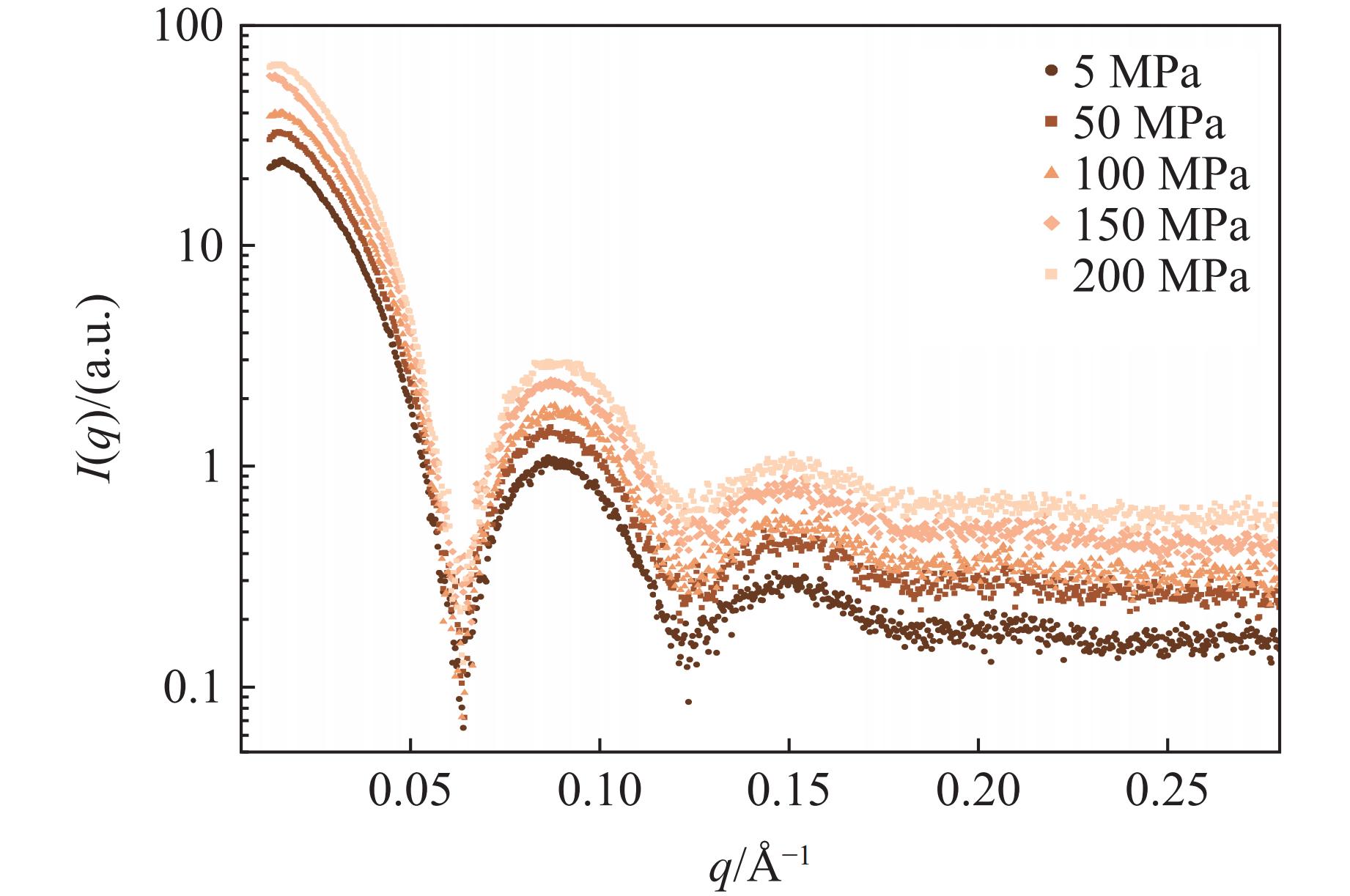
类似地,本课题组也研究了重组人源重链铁蛋白在不同压力下的表现,结果如图6所示。在不同物种中均发现有铁蛋白参与生物体内的铁代谢。人铁蛋白是由24个蛋白亚基构成的中空球状结构,外径约为12 nm,内径约为8 nm,是很好的模式蛋白。该蛋白由实验室制备,制备方法参考文献[23]。2017年,Wang等[24]将高压技术作用于铁蛋白,促使铁蛋白结构松散开,从而使小分子抗癌药物阿霉素(Doxorubicin,DOX)进入铁蛋白内部。他们推测,铁蛋白在500 MPa仍然能够维持球蛋白结构,但受表征手段的限制,没有铁蛋白在压力下维持笼状结构的证据。
铁蛋白作为笼状蛋白,可以视为一个中空的球壳,其散射曲线具有特征性。图6为不同压力下铁蛋白的散射曲线,可以发现,随着压力的增加,铁蛋白散射曲线的变化趋势保持一致,进而可以证明,在200 MPa的压力下,铁蛋白仍然维持着笼状结构,证实了文献[23]的推测。至于更高压力下铁蛋白的表现,还需进一步研究。
3. 结 论
SAXS是一种测量蛋白质结构信息的有效方法。由于蛋白质的散射信号较弱,因此,对SAXS样品池有严格的要求。设计开发了一种用于高压溶液X射线的实验装置,压腔及加压泵站的最高设计压力为500 MPa;快接头管线的最高压力为250 MPa;泵站与压腔之间的连接管线最高压力为400 MPa;离线测试过程中,压力达到300 MPa。溶菌酶和铁蛋白实验证明了生物大分子高压溶液散射方法的可行性。该装置可以很好地满足同步辐射实验的时间有限性和高压实验的复杂性要求,只需要1~2人就可以完成高压溶液散射实验。该装置丰富了BL19U12线站的研究技术,扩展了线站开展高压下溶液自组装、高压生物反应等软物质科学研究的能力。
感谢国家蛋白质科学研究(上海)设施规模化蛋白质制备系统李洁博士在样品制备上提供的帮助,感谢北京宜捷材料科技有限公司王磊、朱君博士在装置制造中提供的帮助。
-
图 3 加压装置结构示意图(HPG为手动加压泵,V1和V2为高压针阀,PT1和PT2为压力表,R为传压介质存储罐,O为压力出口)
Figure 3. Structural diagram of the pressurized device(HPG is the manual pressure pump; V1 and V2 are the high pressure needle valves; PT1 and PT2 are the pressure gauges; R is the pressure transmission medium storage tank; O is the pressure outlet.)
图 4 高压散射实验现场照片(加压泵站与压腔通过高压管线(蓝色)连接,压腔通过专用的底座安装于位移平台)
Figure 4. Photos of high pressure scattering experiment (The pump station is connected with the pressure chamber through the high pressure pipeline (blue), and the pressure chamber is installed on the displacement platform through a special base.)
-
[1] SILVA J L, OLIVEIRA A C, VIEIRA T C R G, et al. High-pressure chemical biology and biotechnology [J]. Chemical Reviews, 2014, 114(14): 7239–7267. doi: 10.1021/cr400204z [2] SCHROER M A, PAULUS M, JEWORREK C, et al. High-pressure SAXS study of folded and unfolded ensembles of proteins [J]. Biophysical Journal, 2010, 99(10): 3430–3437. doi: 10.1016/j.bpj.2010.09.046 [3] BROOKS N J, SEDDON J M. High pressure X-ray studies of lipid membranes and lipid phase transitions [J]. Zeitschrift für Physikalische Chemie, 2014, 228(10/11/12): 987–1004. doi: 10.1515/zpch-2014-0602 [4] KRZYŻANIAK A, BARCISZEWSKI J, FÜRSTE J P, et al. A-Z-RNA conformational-changes effected by high-pressure [J]. International Journal of Biological Macromolecules, 1994, 16(3): 159–162. doi: 10.1016/0141-8130(94)90044-2 [5] OTAKE T, TANIGUCHI T, FURUKAWA Y, et al. Stability of amino acids and their oligomerization under high-pressure conditions: implications for prebiotic chemistry [J]. Astrobiology, 2011, 11(8): 799–813. doi: 10.1089/ast.2011.0637 [6] BLANCHET C E, SVERGUN D I. Small-angle X-ray scattering on biological macromolecules and nanocomposites in solution [J]. Annual Review of Physical Chemistry, 2013, 64: 37–54. doi: 10.1146/annurev-physchem-040412-110132 [7] KÖNIG N, PAULUS M, JULIUS K, et al. Antibodies under pressure: a small-angle X-ray scattering study of immunoglobulin G under high hydrostatic pressure [J]. Biophysical Chemistry, 2017, 231: 45–49. doi: 10.1016/j.bpc.2017.05.016 [8] SOMKUTI J, SMELLER L. High pressure effects on allergen food proteins [J]. Biophysical Chemistry, 2013, 183: 19–29. doi: 10.1016/j.bpc.2013.06.009 [9] 李晓东, 袁清习, 徐伟, 等. 第四代高能同步辐射光源HEPS及高压相关线站建设 [J]. 高压物理学报, 2020, 34(5): 050101. doi: 10.11858/gywlxb.20200554LI X D, YUAN Q X, XU W, et al. Introduction of fourth-generation high energy photon source HEPS and the beamlines for high-pressure research [J]. Chinese Journal of High Pressure Physics, 2020, 34(5): 050101. doi: 10.11858/gywlxb.20200554 [10] 杨科, 蒋升, 闫帅, 等. 上海同步辐射光源高压相关线站概述 [J]. 高压物理学报, 2020, 34(5): 050102. doi: 10.11858/gywlxb.20200584YANG K, JIANG S, YAN S, et al. Application of Shanghai synchrotron radiation source in high pressure research [J]. Chinese Journal of High Pressure Physics, 2020, 34(5): 050102. doi: 10.11858/gywlxb.20200584 [11] KUNZ M, MACDOWELL A A, CALDWELL W A, et al. A beamline for high-pressure studies at the Advanced Light Source with a superconducting bending magnet as the source [J]. Journal of Synchrotron Radiation, 2005, 12(5): 650–658. doi: 10.1107/S0909049505020959 [12] LI X D, LI H, LI P S, et al. A high-pressure single-crystal-diffraction experimental system at 4W2 beamline of BSRF [J]. Journal of Synchrotron Radiation, 2017, 24(3): 699–706. doi: 10.1107/S1600577517003393 [13] ROTHKIRCH A, GATTA G D, MEYER M, et al. Single-crystal diffraction at the extreme conditions beamline P02.2: procedure for collecting and analyzing high-pressure single-crystal data [J]. Journal of Synchrotron Radiation, 2013, 20(5): 711–720. doi: 10.1107/S0909049513018621 [14] HIRAO N, KAWAGUCHI S I, HIROSE K, et al. New developments in high-pressure X-ray diffraction beamline for diamond anvil cell at SPring-8 [J]. Matter and Radiation at Extremes, 2020, 5(1): 018403. doi: 10.1063/1.5126038 [15] PRESSL K, KRIECHBAUM M, STEINHART M, et al. High pressure cell for small- and wide-angle X-ray scattering [J]. Review of Scientific Instruments, 1997, 68(12): 4588–4592. doi: 10.1063/1.1148436 [16] ANDO N, CHENEVIER P, NOVAK M, et al. High hydrostatic pressure small-angle X-ray scattering cell for protein solution studies featuring diamond windows and disposable sample cells [J]. Journal of Applied Crystallography, 2008, 41(1): 167–175. doi: 10.1107/S0021889807056944 [17] BROOKS N J, GAUTHE B L L E, TERRILL N J, et al. Automated high pressure cell for pressure jump X-ray diffraction [J]. Review of Scientific Instruments, 2010, 81(6): 064103. doi: 10.1063/1.3449332 [18] CINAR S, AL-AYOUBI S, STERNEMANN C, et al. A high pressure study of calmodulin-ligand interactions using small-angle X-ray and elastic incoherent neutron scattering [J]. Physical Chemistry Chemical Physics, 2018, 20(5): 3514–3522. doi: 10.1039/C7CP07399B [19] LEHOFER B, GOLUB M, KORNMUELLER K, et al. Structural effects of high hydrostatic pressure on human low density lipoprotein revealed by small angle X-ray and neutron scattering [J]. Biophysical Journal, 2016, 110(3): 255a–256a. doi: 10.1016/j.bpj.2015.11.1403 [20] ABE H, HAMAYA N, KOYAMA Y, et al. Long periodic structure of a room-temperature ionic liquid by high-pressure small-angle X-ray scattering and wide-angle X-ray scattering: 1-decyl-3-methylimidazolium chloride [J]. ChemPhysChem, 2018, 19(12): 1441–1447. doi: 10.1002/cphc.201701273 [21] LI Y W, LIU G F, WU H J, et al. BL19U2: small-angle X-ray scattering beamline for biological macromolecules in solution at SSRF [J]. Nuclear Science and Techniques, 2020, 31(12): 117. doi: 10.1007/s41365-020-00825-3 [22] ORTORE M G, SPINOZZI F, MARIANI P, et al. Combining structure and dynamics: non-denaturing high-pressure effect on lysozyme in solution [J]. Journal of the Royal Society Interface, 2009, 6(Suppl 5): S619–S634. doi: 10.1098/rsif.2009.0163.focus [23] SONG X T, ZHENG Y X, ZHU L, et al. Development of robust and facile purification process for production of recombinant human ferritin heavy chain nanoparticle from Escherichia coli [J]. Process Biochemistry, 2021, 104: 1–9. doi: 10.1016/j.procbio.2021.02.014 [24] WANG Q, ZHANG C, LIU L P, et al. High hydrostatic pressure encapsulation of doxorubicin in ferritin nanocages with enhanced efficiency [J]. Journal of Biotechnology, 2017, 254: 34–42. doi: 10.1016/j.jbiotec.2017.05.025 -








 下载:
下载:




 下载:
下载: